COLEGIO
LA TOSCANA LISBOA IED
ESTRATEGIA
APRENDE EN CASA - QUIMICA
GRADO
GUIA N° 7
PARA REALIZAR LA SEMANA DEL 26 AL 29
DE MAYO DEL 2020
FECHA ENTREGA MAYO 28 DEL 2020
DOCENTE ESPERANZA GOMEZ CABIATIVA
DBA: Explica la variación de algunas de las
propiedades de la tabla periódica, (densidad, temperatura, electronegatividad,
punto de ebullición, punto de fusión), de sustancias simples, metales, no
metales, metaloides, gases nobles en la tabla periódica.
TEMA: PROPIEDADES PERIÓDICAS DE LA TABLA
OBJETIVO: Destacar
propiedades periódicas de los elementos químicos de la tabla periódica.
APRECIADO ESTUDIANTE
NO OLVIDAR ENVIAR
AL CORREO ELECTRÓNICO esperanzacabiatiba@gmail.com , ESCRIBIENDO SU NOMBRE
APELLIDO Y GRADO EN ESTE CORREO SE
RECIBEN LAS ACTIVIDADES Y/O
AUTOEVALUACIONES, DE LA PRESENTE
GUÍA, LO DEMÁS SE DEBE REALIZAR EN EL CUADERNO DE QUIMICA, ENUMERANDO LA GUÍA CON EL PROPÓSITO DE QUE AL
REGRESO REVISARLAS Y CORREGIR DUDAS. MIL
GRACIAS POR SU DEDICACIÓN Y ATENCIÓN
FUNDAMENTO TEÓRICO.
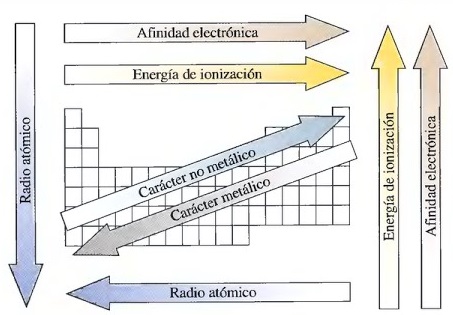
PROPIEDADES PERIÓDICAS DE LA TABLA
Las propiedades
periódicas de la tabla periódica son: Electronegatividad, Energía de
Ionización, Afinidad electrónica, Radio Iónico, Radio atómico. Veamos cada una
de ellas y su variación a través de la imagen:
La
dirección de las flechas superpuestas en la tabla periódica indican la forma
como estas propiedades aumentan en la tabla periódica.
Electronegatividad. Es una
medida de la fuerza de atracción que ejerce un átomo sobre los electrones de
otro en un enlace covalente. Los diferentes valores de electronegatividad se
clasifican según diferentes escalas, entre ellas la escala de Pauling y la
escala de Mulliken. cuyo valor máximo es 4
que es el valor asignado al flúor, el elemento más
electronegativo. El elemento menos electronegativo, el cesio, tiene
una electronegatividad de 0,7 siendo más electropositivo.
La afinidad
electrónica es una medida de la variación de energía, cuando se añade
un electrón a un átomo neutro para formar un ion negativo. Por ejemplo, cuando
un átomo de cloro neutro en forma gaseosa recoge un electrón para formar un ion
Cl-, libera una energía de 349 kJ/mol o 3,6 eV/átomo.
ACTIVIDAD GUIA N° 7 DE QUIMICA SEMANA MAYO 26 AL 29 DE MAYO
FECHA DE ENTREGA ACTIVIDAD MAYO 29
1.Copie la
información que aparece en la presente guía en su cuaderno de química
2.Con la ayuda de la
siguiente tabla periódica encuentre la diferencia del valor de la
electronegatividad de los átomos como se deja ver en el ejemplo:
Ejemplo: en la formación de la molécula de HF el valor de la electronegatividad
es para el elemento Hidrógeno 2.1 y para el flúor 4.0 como lo deja ver la tabla
entonces la diferencia será:
Diferencia electronegatividad 4.0 del flúor menos - 2.1 del hidrógeno=1.9(realizando
la resta) 4.0 - 2.1 = 1.9
1. AHORA ENCUENTRA EL VALOR DE LA DIFERENCIA
DE LA ELECTRONEGATIVIDAD PARA LAS SIGUIENTES PAREJAS DE
A. Bromo y
Francio
B. Hierro
y Oxígeno
C. Oxígeno
y Estaño
D. Cesio
y Yodo
E.
Aluminio y Oxígeno
F. Carbono e Hidrógeno
G. Cloro
e Hidrógeno
H.
Potasio y Yodo
I.
Selenio y Oxígeno
J. Bario y
Cloro
¡NO OLVIDAR EL LAVADO DE MANOS Y
NO SALIR DE CASA! CUIDATE MUCHO



Comentarios